Гипокситерапия и эпилептический процесс
Федин А.И., Старых Е.В.
Российский государственный медицинский университет, г. Москва
Реферат. Приведены результаты экспериментальных исследований, свидетельствующие о наличии зависимости между резистентностью к гипоксии и судорожной устойчивостью на примере фармакологического киндлинга. Показано, что высокоустойчивые к гипоксии животные являются более устойчивыми к действию конвульсанта. На основе ЭЭГ-исследования предполагаются возможные механизмы этой устойчивости. Представлен клинический материал, свидетельствующий об эффективности использования адаптации к гипоксии в комплексном лечении больных эпилепсией.
Основу естественной профилактики и лечения болезней составляют адаптационные, приспособительные реакции к факторам внешней среды и изменениям, происходящим в самом организме. Доказано, что повторяющееся прерывистое гипоксическое воздействие успешно применяется при лечении многих заболеваний [2,4, 8,9,10], хотя механизмы лечебного действия прерывистой гипоксии не вполне ясны.
В своей работе мы попытались выяснить наличие связи между судорожной и гипоксической устойчивостями и выявить возможные ее механизмы. С этой целью была проведена серия экспериментов, в ходе которых изучались закономерности формирования судорожной готовности у низкоустойчивых (НУ) и высокоустойчивых (ВУ) к недостатку кислорода крыс. В работе использована модель фармакологического киндлинга - ежедневных введений эпилептогена в подпороговых дозах.
Животных предварительно поднимали на 11000 метров со скоростью 183 м/с в барокамере. Определяли время жизни (ВЖ), то есть длительность периода от момента подъема на высоту до обратимой остановки дыхания. Из всей выборки отбирали крыс с низкой и высокой резистентностью к гипоксии (по 31 животному в каждой группе). Через 3-5 дней после определения устойчивости к гипоксии крысам ежедневно внутрибрюшинно вводили коразол в подпороговой дозе 25 мг/кг в течение 30 дней. Формирующиеся при этом судорожные реакции выражали в баллах, приняв следующую шкалу: 0 баллов - отсутствие судорожной реакции, 1 балл - миоклонические вздрагивания головы и туловища, 2 балла - клонические судороги передних конечностей, 3 балла - подъем на задние конечности (поза "кенгуру") или мощные повторные клонические судороги, 4 балла - тонико-клонические судороги с падением животного на бок, 5 баллов - смертельные судороги или многократные падения на бок.
Среднее время жизни НУ к гипоксии животных равнялось 3,07 ± 0,2 минуты, ВУ животных - 11,69 ± 0,6 минуты (Р < 0,1).
Первая реакция на введение подпороговой дозы коразола оказалась более выраженной у ВУ животных (рис.1). У 3 из них 1-я инъекция этого препарата вызвала судорожные реакции интенсивностью в 1 балл (миоклонические вздрагивания мышц морды, ушей, туловища). Однако уже начиная со 2-го введения интенсивность судорожных проявлений была выше у НУ к гипоксии животных.
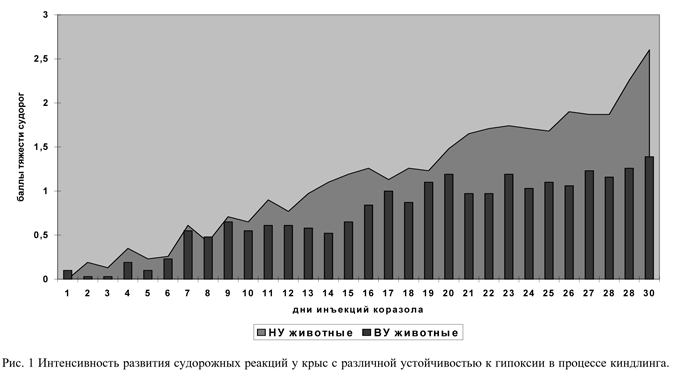
Достоверные различия в интенсивности судорожных проявлений между группами НУ и ВУ крыс обнаружились на 22-й день введения конвульсанта (Р < 0,05). Средняя тяжесть реакций у НУ животных в этот день составляла 1,71 ± 0,29 балла, а у ВУ крыс - 0,97 ± 0,23 балла. В первой группе животных судорожные реакции развились у 20 крыс, причем у 5 из них тяжесть этих проявлений соответствовала 1 баллу, у 4 - 2 баллам, у 7 - 3 баллам, у одного - 4 баллам и у 3 из них наблюдались многократные падения на бок. В группе ВУ животных в этот период судорожные реакции развились только у 14 крыс, причем наиболее тяжелые судорожные проявления тяжестью в 4 балла не наблюдались ни у одного животного, а в 5 баллов - только у одной крысы. В группе ВУ животных, в отличие от НУ крыс, повышение агрессивности наблюдалось лишь у отдельных особей.
К концу формирования феномена "раскачки" средняя тяжесть судорожных проявлений в группе НУ животных примерно в 2 раза превышала таковую у ВУ крыс (2,6 ± 0,29 балла у НУ крыс и 1,39 ± 0,26 балла у ВУ; Р < 0,01). При этом в группе НУ крыс тяжесть судорожных проявлений, соответствовавшая 1 баллу, наблюдалась у 8 животных, 2 баллам - у 3, 3 баллам - у 5, 4 баллам - у 8 и 5 баллам - у 4. ВУ крысы по окончании исследования развили судорожные реакции тяжестью в 1 балл в 8 случаях, в 2 балла - в 6 , 3 балла - в 3,4 балла - в одном, 5 баллов - в 2 случаях. В группе НУ животных к концу формирования феномена "раскачки" судорожные реакции развились у 28 крыс, причем трое из них погибли; из группы ВУ крыс судорожными изменениями было охвачено 20 особей и только у одной они оказались смертельными.
Таким образом, проведение фармакологического киндлинга выявило наличие зависимости между судорожной устойчивостью и резистентностью к гипоксии. При большей резистентности к недостатку кислорода у животных судорожная устойчивость выше, что проявляется в более медленном нарастании судорожных реакций, чем в группе НУ животных. Выраженность эмоционально-поведенческих расстройств коррелировала с тяжестью судорожных проявлений - нарастание судорожных реакций сопровождалось нарастанием агрессивности у животных.
Вместе с тем было замечено, что в группе НУ животных развитие коразолового киндлинга протекает в 2 этапа. Первый из них характеризуется появлением периодов замираний и отдельных миоклонусов, что напоминает картину малого эпилептического пароксизма у человека. Во время 2-го этапа развиваются генерализованные тонико-клонические судороги, сопровождаемые гиперсаливацией и постприступной депрессией. В группе ВУ животных лишь единичные особи проходили через второй период развития фармакологического киндлинга с нарушениями, присущими большому эпилептическому припадку.
Наша работа согласуется с исследованиями других авторов, в ходе которых была выявлена взаимосвязь между судорожной устойчивостью и резистентностью к гипоксии на других моделях эпилепсии: электросудорожного приступа [3], системного введения стрихнина и аппликаций пенициллина на сенсомоторную кору [1].
Учитывая, что устойчивость животных к действию судорожного агента зависит от резистентности к гипоксии, в своей последующей работе мы попытались выяснить механизмы этой устойчивости путем проведения ЭЭГ контроля у ВУ крыс по мере развития феномена "раскачки". Для этого через 3-5 дней после определения индивидуальной устойчивости к гипоксии крысам вживляли электроды в сенсомоторную область коры (поля 3, 4, 6 по атласу Kreig [12]), хвостатое ядро и гиппокамп. Операцию проводили под гексеналовым наркозом (150 мг/кг внутрибрюшинно). Обездвиженное животное фиксировали в стереотаксическом аппарате. Производили трепанацию черепа в точках, соответствующих расположению указанных выше структур. Координаты определяли по атласу Е.Фифковой и Дж.Маршала (Я.Буреш и др., [11]): кора - АР=0, 1=3, Н=0; хвостатое ядро - АР= -2, 1=2, Н=4,5-5,0 гиппокамп - АР=2,1, 1=0,8-1,0, Н=3,3. В указанные точки стереотаксически вводили электроды. Индифферентный электрод крепили в носовых костях черепа. На поверхности черепа электроды фиксировали с помощью пластмассы "Норакрил". Через 3-5 дней после операции крысам регулярно в течение 30 дней вводили коразол в дозе 25 мг/кг внутрибрюшинно. Наряду с оценкой поведенческих нарушений, развивающихся в процессе последовательных стимуляций, осуществляли суммарную запись биотоков мозга с указанных структур и их частотный анализ на восьмиканальной электроэнцефалографической установке фирмы "Медикор" (Венгрия), состоящей из электроэнцефалографа и полосового анализатора.
Визуальное наблюдение и ЭЭГ регистрацию проводили сразу после введения коразола в течение получаса. На ЭЭГ анализировали свободные от эпилептиформной активности участки.
Выявлено, что в процессе развития фармакологического киндлинга у ВУ к гипоксии животных возникают определенные изменения ЭЭГ показателей в гиппокампе, хвостатом ядре и сенсомоторной коре (рис. 2). Анализируя эти изменения, мы заметили, что во всех перечисленных выше структурах по мере развития судорожной готовности наблюдается достоверное замедление основного (альфа) ритма (Р < 0,01 - 0,1), сопровождаемое повышением его амплитуды (отличия во всех структурах достоверны, Р < 0,05- 0,01).
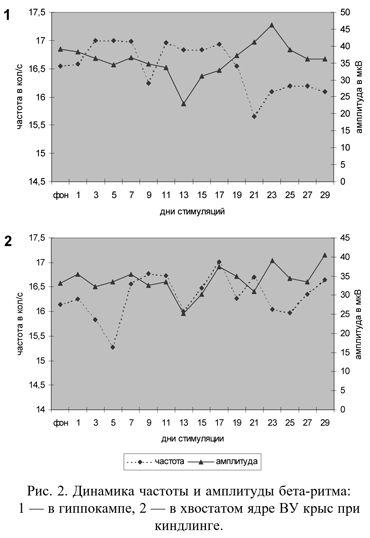
Динамика частоты и амплитуды дельта-активности в хвостатом ядре напоминает таковую в гиппокампе: медленное повышение амплитуды дельта-активности в процессе формирования феномена "раскачки" при незначительном замедлении ритма. Периоды наибольших и наименьших значений данных показателей в большинстве случаев совпадают в обеих структурах головного мозга. В то же время гиппокамп и хвостатое ядро существенным образом отличаются друг от друга характером изменения основных характеристик бета-активности по мере нарастания числа стимуляций. Так, в гиппокампе в первые 18 дней введения конвульсанта частота бета-активности значительно повышается, а амплитуда понижается. Уже после 13-14 введений коразола амплитуда бета-активности в гиппокампе достоверно снизилась с 39,1 ± 2,6 мкВ в фоне до 23,1 ± 6,5 мкВ (Р < 0,05), и только на более поздних сроках киндлинга (после 18 дней стимуляции) обнаруживается противоположная закономерность.
В хвостатом ядре амплитуда бета-активности в течение первых 12 стимуляций остается практически неизменной, после чего претерпевает определенные колебания, в которых не прослеживается закономерности. Для частоты бета-ритма характерно достоверное урежение во время первых 6 стимуляций (Р < 0,05)., Частота бета-активности после 5-6 инъекции коразола понижается от 6,1 ± 0,3 кол/с до 15,28 ± 0,2 кол/с.
Известно, что гиппокамп относится к числу структур проэпилептической системы. В соответствии с учением Г.Н Крыжановского, патологическая система с самого начала развития патологического процесса сама является стимулом для активации антисистемы, что во многих случаях обеспечивает купирование патологического процесса [6]. Другими авторами показано, что при электрической стимуляции гиппокампа в диапазоне быстрых частот (10-30 Гц) возникают тормозные эффекты в ретикулярной формации мозга [5], которая относится к числу структур антиэпилептической системы. В соответствии с приведенными выше данными можно предположить, что одним из механизмов повышенной устойчивости к действию конвульсанта в процессе развития феномена "раскачки" в группе животных с повышенной устойчивостью к гипоксии являются изменения в гиппокампе (повышение частоты бета-ритма в первые 18 дней введения конвульсанта и понижение его амплитуды), которые наряду с проконвульсивными эффектами с первых же введений коразола запускают антиэпилептическую систему.
В свете изложенного становится понятным и тот факт, что первая реакция на введение подпороговой дозы коразола оказалась более выраженной у ВУ животных. В этой группе животных на более ранних сроках по сравнению с НУ животными развились изменения в гиппокампальной области.
В своей дальнейшей работе мы попытались воздействовать на эпилептический процесс, повышая устойчивость организма к гипоксии путем адаптации к недостатку кислорода. Первоначально в экспериментальных исследованиях было установлено, что адаптация к гипоксии повышает не только гипоксическую, но и судорожную устойчивость у животных. Дальнейшее изучение было проведено у 51 больного с эпилепсией (парциальной и вторично-генерализованной формами), которые не только принимали противоэпилептические препараты, но и получали сеансы прерывистой нормобарической гипокситерапии (ПНГ) - 20 сеансов длительностью один час каждый. Дыхание осуществляли с использованием гипоксикатора "Био-Нова 204" в циклично-фракционном режиме. До адаптации, после 1, 4 и 20-го сеансов производили ЭЭГ контроль на 16-канальном анализаторе "Альфа-УЭБ-Т-16-01". С помощью монополярных отведений потенциалов регистрировали суммарную спектральную мощность и спектральную мощность альфа-, тета-, дельта- и бета-1-активности в различных областях головного мозга спустя 10-60 минут после проведенного сеанса гипокситерапии. Анализировали свободные от эпилептиформной активности участки ЭЭГ.
Отмечено, что адаптация к гипоксии привела к урежению и сокращению длительности припадков, облегчению постприступного состояния. У 34 больных после ПНГ количество припадков уменьшилось на 50% и более. Сокращение числа припадков отмечалось уже при проведении сеансов ПНГ- почти в 2 раза по сравнению с фоновыми данными (рис. 3). Если в течение месяца до адаптации общее количество припадков у этих больных составляло 402, то в течение курса ПНГ оно сократилось до 227. Минимальное количество приступов наблюдалось в течение первых 4 месяцев после окончания тренировочного курса (соответственно 177, 99, 124 и 154). После этого срока эпилептические припадки несколько участились и на 6-м месяце составили 235.
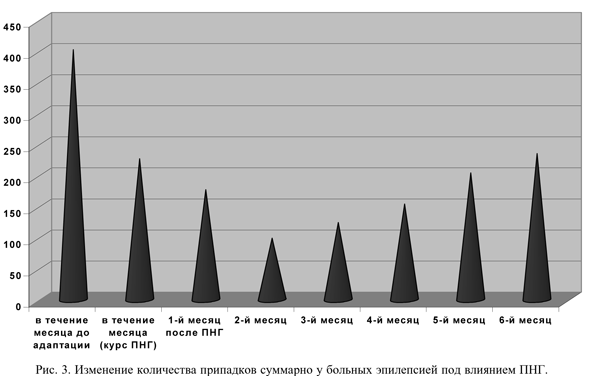
У 7 больных с фоновой частотой припадков до одного раза в месяц после гипокситерапии приступы не наблюдались в течение полугода. Среди больных с первоначальными приступами до одного раза в неделю межприступные интервалы после лечения удлинились до 2 месяцев у 4, до 3 - у 2, до 4 и 5 - у 4. У пациентки с первоначальными ежедневными припадками в течение последующего полугода возникло только 5 пароксизмов. Примерно на 1/3 удалось сократить количество приступов у 2 больных с первоначальной частотой до 3 раз в день. После лечения в ряде случаев не наблюдалось перерастания парциального припадка в генерализованный тонико-клонический приступ. Более отчетливо проявлялась аура. Стала наблюдаться приуроченность приступов к определенному времени суток. У больных, прошедших курс ПНГ, нормализовались сон и поведенческие реакции, уменьшилась агрессивность, повысилась работоспособность. Ухудшения состояния за время курса ПНГ ни у одного больного не произошло.
Компьютерная ЭЭГ в процессе гипокситерапии показала достоверное повышение суммарной спектральной мощности, а также спектральных мощностей альфа-, тета- и дельта-активности для большинства областей головного мозга (Р < 0,05). Максимумы данных спектров ЭЭГ приходились преимущественно на последний - 20-й день адаптации. Наибольшие значения бета-активности наблюдались после 4-го сеанса ПНГ.
Электроэнцефалографический контроль при проведении гипоксической стимуляции имеет особую важность в связи с тем, что биоэлектрические процессы, протекающие в нервных клетках и определяющие степень возбудимости, кислородозависимы. В определенных случаях вместо тормозного можно вызвать усиливающий эффект.
При проведении ЭЭГ-контроля в своих исследованиях мы опирались на результаты ЭЭГ, полученные В.Б.Малкиным в процессе непрерывно нарастающей гипоксии [7]. Первоначально он выделил фазу активации бета-ритма, которая по времени совпадает с развитием приспособительных реакций со стороны дыхания и кровообращения. Следующая фаза характеризуется активностью альфа-, затем тета-и дельта-волн, после которой возможно снижение частоты и амплитуды этих активностей с последующей депрессией ЭЭГ показателей. Поэтому при ПНГ, как и при лечении медикаментозными средствами, необходимо тщательно подбирать и корректировать режимы воздействия. Полученный нами экспериментальный и клинический материал свидетельствует о наличии корреляции между судорожной устойчивостью и резистентностью к гипоксии, а также об эффективности и перспективности использования метода гипокситерапии в комплексном лечении эпилепсии.
Литература
1. Агаджанян Н.А., Торшин В.И. Дейстиве судорожных агентов на животных с различной индивидуальной устойчивостью к гипоксической гипоксии // Бюлл. экспер. биол. и мед. - 1983.----Т. 95. - № 6. - С.20-22.
2. Анохин М.И., Даирова Р.А., Снегоцкая М.Н., Курочкина А.Г. Влияние прерывистых гипоксических ингаляций на некоторые показатели функций легких у детей, больных бронхиальной астмой // Эколого-физиологические проблемы адаптации. - Мат.VII Всероссийского симпозиума - М., 1994.- С.17.
3. Березовский В.А. Гипоксия и индивидуальные особенности реактивности. - Киев, 1978.
4. Березовский В.А., Левашов М.И. Физиологические предпосылки и механизмы нормализующего действия нормобарической гипоксии и оротерапии // Физиол. журн. - 1992. - Т. 38. - № 5. - С.3-12.
5. Виноградова О.С. Структурно-функциональные представления об организации процесса регистрации информации лимбической системой. - Лимбическая система. Нейрохимические и нейрофизиологические исследования. - Пущино-на-Оке, 1973. - С.7-30
6. Крыжановский Г.Н. Общая патофизиология нервной системы. Руководство. -М., 1997.
7. Малкин В.Б. Острая гипоксия. / Экологическая физиология человека. Адаптация человека к экстремальным условиям среды: Руководство по физиологии. -М., 1979. - С.333-405.
8. Миррахимов М.М. Болезни сердца и горы. - Фрунзе, 1971.
9. Стрелков Р.Б., Белых А.Г., Караш Ю.М. и др. Повышение сопротивляемости организма к различным экстремальным факторам с помощью нормобарической гипоксической стимуляции // Вести. АМН СССР. - 1988. - № 5. - С.77-80.
10. Чижов А.Я., Осипенко А.В. О механизмах адаптации организма к дозированной гипоксической гипоксии // Пат. физиол. и экспер. тер. - 1980. - № 1. - С. 69-72.
11. Буреш Я., Петранъ Н., Захар И. Электрофизиологические методы исследования. - М., 1962.
12. Kreig W.J.S. Connection of the cerebral cortex. I. The albino rat. A topography of the cortical areas // J. Сотр. Neural. - 1946. - Vol. 84. - № 2. - P. 221-275.
Федин А.И., Старых Е.В. Гипокситерапия и эпилептический процесс // Неврологический вестник. - 2001. - Т. XXXIII, вып. 3-4. - С.29-34.



